En la imagen se muestra la famosa ecuación de Albert Einstein, que expresa como la materia se puede transformar en energía y la energía se puede transformar en materia. Esta ecuación es una equivalencia y no una forma de energía.
Materia:
- La materia es todo aquello que nos rodea.


Todo lo que nos rodea es materia: Unas sillas un vaso … Las dos imágenes que se muestran superiormente a este texto muestran formas de materia.
- Se denomina materia todo aquello que tiene masa y que ocupa un lugar en el espacio, es decir un volumen.

Toda la materia tiene masa y volumen.
- Las propiedades de la materia se clasifican en dos grupos: generales(masa y volumen) y específicas(color, dureza etc)
- La materia se presenta en tres estados de agregación: sólido, líquido y gaseoso.
- Cuando las partículas de una substancia ganan o pierden energía la substancia puede cambiar de estado. Cambios de estado:
En las siguientes imágenes se ilustran los cambios de estado de agregación:


De sólido a líquido: Fusión. De líquido a gas: vaporización. De sólido a gas: Sublimación. De gas a líquido: Condensación. De líquido a sólido: Solidificación. De gas a sólido: Sublimación inversa.
Un ejemplo de sublimación es el hielo seco que se utiliza por ejemplo en los conciertos.
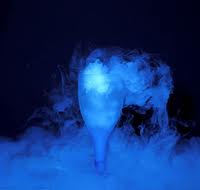
HIELO SECO
Características de los estados de agregación:

En esta imagen se ven resumidas las características de los estados de agregación de un modo visual.
Gas:
-Masa fija a menudo muy pequeña para su gran volumen.
-No tiene un volumen fijo: puede ser comprimido. Tiende a ocupar el máximo volumen.
-No tiene forma fija: puede fluir (viento). Tiende a ocupar la forma del recipiente.
-Sus fuerzas de repulsión son mucho mayores que las de atracción.
–Difusión: Las partículas de un gas se mueven tan rápida y aleatoriamente (están en constante movimiento y su movimiento es de traslación) que se distribuyen en todas las direcciones hasta que encuentran la pared del recipiente que las contiene, esto es porque sus fuerzas de repulsión son mayores que las de atracción. Esta es la razón de que dos gases se mezclen por completo entre sí.
-Teoría cinético-molecular:
Tanto las características de los estados de la materia como los procesos de cambio que en esta se suceden son explicados mediante la llamada teoría cinético – molecular que podemos resumir de la siguiente manera:
Una muestra gaseosa está constituida por un enorme número de partículas de tamaño muy pequeño y a unas distancias unas de otras mucho mayor que el citado tamaño. Las partículas se mueven en un movimiento rectilíneo y uniforme, caotico, y con choques perfectamente elásticos todo ello regido por unas fuerzas que pueden ser de atracción y de repulsión.
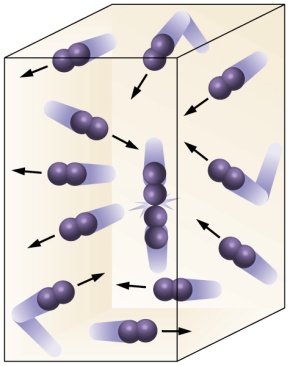
Esta imagen resume de un modo visual la teoría cinético – molecular. Se trata de una muestra gaseosa en un recipiente y las partículas chocando entre ellas, con choques perfectamente elásticos y con un M.R.U caótico. Todo ello regido por unas fuerzas de atracción y repulsión.
Para expresar correctamente su estado de la materia hay que definir la presión, el volumen y la temperatura.
Líquido:
– Sus partículas tienen movimientos de traslación.
-Masa fija.
-Volumen fijo: incompresible.
-Tiende a ocupar la forma del recipiente. Sus fuerzas de atracción y repulsión son semejantes.
-Fluible.
-Sus fuerzas de atracción son equivalentes a las de repulsión.
Para determinar el estado de materia sólo necesitamos la temperatura.
Sólido:
-Sus partículas vibran.
-Masa fija.
-Volumen fijo.
-Incompresible.
-Sus fuerzas de atracción son mucho mayores que las de repulsión.
-Forma fija.
-Es incompresible e influible.
-Pueden ser cristalinos(enfriamiento lento, las partículas han tenido tiempo de formar redes ordenadas) y amorfos “polvos” (enfriamiento rápido, las partículas no han tenido tiempo de ordenarse).
Sus fuerzas de atracción son mayores que las de repulsión.
Para determinar el estado de materia sólo necesitamos la temperatura.
-Puntos de fusión y ebullición: Temperaturas a las que las sustancias puras cambian de estado. Se utilizan para: reconocer sustancias y para comprobar la pureza.
Sublimación – Sólido a gas – Hielo seco (yodo – CO2).

No hay comentarios:
Publicar un comentario